3 ekscytujące sposoby, w jakie chemicy skonstruowali związki chemiczne w tym roku
przez Bethany Halford
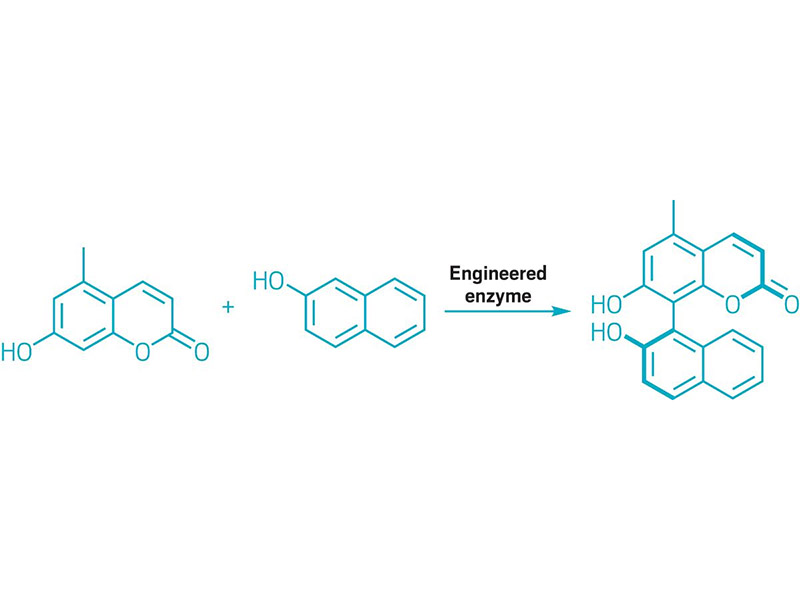
EWOLUOWANE ENZYMY ZBUDOWAŁY WIĄZANIA BIARYLOWE
Schemat ilustrujący sprzęganie biarylowe katalizowane enzymem.
Chemicy wykorzystują cząsteczki biarylowe, które charakteryzują się grupami arylowymi połączonymi ze sobą pojedynczym wiązaniem, jako chiralne ligandy, elementy budulcowe materiałów i produkty farmaceutyczne. Jednak tworzenie motywu biarylowego za pomocą reakcji katalizowanych metalami, takich jak reakcje sprzęgania Suzuki i Negishiego, zazwyczaj wymaga kilku etapów syntezy, aby uzyskać partnerów sprzęgania. Co więcej, te reakcje katalizowane metalami zawodzą podczas tworzenia dużych biaryli. Zainspirowany zdolnością enzymów do katalizowania reakcji, zespół kierowany przez Alison R.H. Narayan z Uniwersytetu Michigan wykorzystał ewolucję kierowaną do stworzenia enzymu cytochromu P450, który buduje cząsteczkę biarylową poprzez oksydacyjne sprzęganie aromatycznych wiązań węgiel-wodór. Enzym łączy cząsteczki aromatyczne, tworząc jeden stereoizomer wokół wiązania z utrudnioną rotacją (pokazano). Naukowcy uważają, że takie podejście biokatalityczne może stać się podstawową transformacją w tworzeniu wiązań biarylowych (Nature 2022, DOI: 10.1038/s41586-021-04365-7).

PRZEPIS NA AMINY TRZECIORZĘDOWE WYMAGAJĄCY ODROBINY SOLI
Schemat przedstawia reakcję, w której z amin drugorzędowych powstają aminy trzeciorzędowe.
Mieszanie metalicznych katalizatorów o dużym zapotrzebowaniu na elektrony z bogatymi w elektrony aminami zazwyczaj niszczy katalizatory, dlatego odczynniki metaliczne nie mogą być użyte do budowy amin trzeciorzędowych z amin drugorzędowych. M. Christina White i współpracownicy z Uniwersytetu Illinois w Urbana-Champaign zdali sobie sprawę, że mogą obejść ten problem, dodając do receptury reagentów słoną przyprawę. Przekształcając aminy drugorzędowe w sole amonowe, chemicy odkryli, że mogą poddać te związki reakcji z terminalnymi olefinami, utleniaczem i katalizatorem w postaci sulfotlenku palladu, tworząc niezliczoną ilość amin trzeciorzędowych z różnymi grupami funkcyjnymi (pokazano przykład). Chemicy wykorzystali tę reakcję do wytworzenia leków przeciwpsychotycznych Abilify i Semap oraz do przekształcenia istniejących leków, które są aminami drugorzędowymi, takich jak lek przeciwdepresyjny Prozac, w aminy trzeciorzędowe, pokazując w ten sposób, w jaki chemicy mogą tworzyć nowe leki z już istniejących (Science 2022, DOI: 10.1126/science.abn8382).
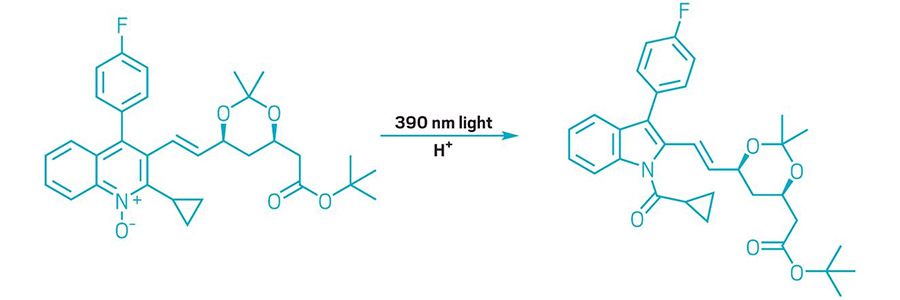
AZAARENY PRZESZŁY KONTRAKCJĘ WĘGLA
Schemat przedstawia przekształcenie N-tlenku chinoliny w N-acyloindol.
W tym roku chemicy poszerzyli repertuar edycji molekularnej, czyli reakcji, które wprowadzają zmiany w rdzeniach złożonych cząsteczek. W jednym z przykładów naukowcy opracowali transformację wykorzystującą światło i kwas do odcięcia pojedynczego atomu węgla z sześcioczłonowych azaarenów w N-tlenkach chinoliny, tworząc N-acyloindole z pierścieniami pięcioczłonowymi (pokazano przykład). Reakcja, opracowana przez chemików z grupy Marka D. Levina z Uniwersytetu Chicagowskiego, opiera się na reakcji z użyciem lampy rtęciowej, która emitowała światło o wielu długościach fal. Levin i współpracownicy odkryli, że użycie diody elektroluminescencyjnej emitującej światło o długości fali 390 nm zapewniło im lepszą kontrolę i pozwoliło na uogólnienie reakcji dla N-tlenków chinoliny. Nowa reakcja daje twórcom cząsteczek sposób na przebudowę rdzeni złożonych związków i może pomóc chemikom medycznym w rozbudowie bibliotek kandydatów na leki (Science 2022, DOI: 10.1126/science.abo4282).
Czas publikacji: 19 grudnia 2022 r.

